Consideremos un sistema que ni absorbe ni cede calor. Si el sistema realiza trabajo, su energía interna disminuye y tal disminución de energía interna es igual al trabajo realizado por el sistema. De la misma manera, podemos incrementar la energía es igual al trabajo realizado.
Cuando se realiza trabajo sobre un sistema o se le suministra calor, la energía interna aumenta. Así mismo, cuando el sistema realiza trabajo o cede calor, la energía interna disminuye. Estos resultados se resumen en la primera ley de la termodinámica, la cual establece que la variación de energía interna de un sistema se expresa como
Donde ΔU representa la variación de la energía interna, Q el calor absorbido o cedido por el sistema y W el trabajo realizado por dicho sistema o el trabajo que se realiza sobre él. El siguiente esquema muestra el criterio de los signos para el calor y el trabajo realizado en un sistema.
Ejemplo
A un gas contenido dentro de un recipiente provisto de un pistón se le suministra 50 J de calor y a este a su vez, como muestra la figura,empuja un objeto de peso 1000N sobre una superficie es 0,2 y el bloque se desplaza con velocidad constante una distancia de 0,50m . Determinar la variación de la energía interna del gas, suponiendo que la fricción entre el émbolo y el cilindro es despreciable.
Solución
Como en este caso, FN= mg =1000N, tenemos que:
Como el bloque se mueve con velocidad constante, la fuerza F ejercida por el gas es igual a la fuerza de rozamiento.
Así, la variación de la energía interna, de acuerdo con la primera ley de la termodinámica es:
En resumen, la primera ley de la termodinámica es una relación entre el trabajo, el calor y la energía interna. Se puede ver reflejado:
- Cuando a un objeto se le transfiere calor aumenta su energía interna, esto se ve reflejado en el aumento de su temperatura.
- Cuando a un gas dentro de un pistón se le comprime este recibe trabajo y eso cambio la energía interna del sistema.
- Una batería cargada tiene mayor energía interna que una batería no cargada.
- El calor que genera el Sol provoca un cambio de la energía de muchas sustancias, por ejemplo del agua, por ello se modifica su estado.
- Cuando licuamos un jugo se le implanta trabajo a la sustancia y esto modifica la energía interna del mismo.
Procesos Termodinámicos
se denomina proceso termodinámico a la evolución de determinadas magnitudes propiamente termodinámicas relativas aún determinado sistema termodinámico. desde el punto de vista de la termodinámica, estas transformaciones deben ocurrir desde un estado de equilibrio inicial y otro final; es decir, que las magnitudes que sufre una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final.
Procesos Adiabático
Un proceso termodinámico en el cual no hay transferencia de calor se conoce como proceso adiabático. Es decir, que en este tipo de procesos se tiene que Q = 0
De acuerdo con la primera ley de la termodinámica, tenemos:
ΔU=Q - W.
Como Q = 0, entonces
ΔU = - W
Para un gas contenido dentro de un cilindro provisto de un pistón, cuyas paredes no permiten la transferencia de calor al exterior, la variación de energía interna es igual al trabajo, ya sea realizado por el sistema o sobre el sistema.

- Cuando el sistema realiza trabajo, dicho trabajo es positivo entonces ΔU es negativo, es decir, que la energía interna disminuye y, en consecuencia, disminuye la temperatura del sistema.
- Cuando se realiza trabajo sobre el sistema, dicho trabajo es negativo, entonces ΔU es positivo, es decir, que la energía interna aumenta y, en consecuencia, aumenta la temperatura del sistema.
Ejemplos cotidianos
Para un gas contenido dentro de un cilindro provisto de un pistón, cuyas paredes no permiten la transferencia de calor al exterior, la variación de energía interna es igual al trabajo, ya sea realizado por el sistema o sobre el sistema.

Saunas
Extintores
Procesos Isotérmico
Termodinámico en el cual la temperatura permanece constante se conoce como proceso isotérmico. Es decir, que en este tipo de procesos la temperatura varía y, en consecuencia, energía interna permanece constante, lo cual significa que ΔU= 0.
Como ΔU= 0, entonces:
Este proceso ocurre cuando un sistema, como gas contenido en un cilindro provisto de un pistón, suministra calor y se producen cambios en la presión y el volumen y, sin embargo, su temperatura permanece constante.

- Cuando el gas absorbe calor, Q es positivo, por tanto el trabajo W es positivo, es decir, que el gas realiza trabajo cuyo valor es igual al calor absorbido. En este caso el gas se expande.
- Cuando se realiza trabajo sobre el gas, comprimiéndolo, W es negativo, luego Q es negativo, es decir, qué el gas cede calor en una cantidad igual al trabajo realizado sobre él.
Ejemplo
Los procesos isotérmicos pueden ocurrir en cualquier tipo de sistema que tenga algún medio para regular la temperatura. Como por ejemplo:
- los cambios de fase de diferentes líquidos a través del proceso de fusión y evaporación son isotérmicos. Por ejemplo, la fusión del hielo a 0°.
- La máquina de Carnot.
- Las reacciones en el refrigerador son isotérmicos y se mantienen en temperatura constante.
- Bomba de calor.
- Las interacciones de una célula con sus células circundantes se realiza mediante procesos isotérmicos.

Proceso Isométrico
Un proceso termodinámico en el cual el volumen permanece constante se conoce como proceso isométrico. Es decir,que en este tipo de procesos el volumen no varía y, en consecuencia, el trabajo es igual a cero, lo cual significa que W = 0 .
De acuerdo con la primera ley de la termodinámica, tenemos:
∆U = Q - W
Cómo W = 0, entonces: Q = ∆U
supongamos que un gas está contenido dentro de un cilindro provisto de un pistón en el que no cambia el volumen.

De acuerdo con la primera ley de la termodinámica, tenemos:
∆U = Q - W
Cómo W = 0, entonces: Q = ∆U
supongamos que un gas está contenido dentro de un cilindro provisto de un pistón en el que no cambia el volumen.
- Cuando el sistema absorbe calor se incrementa la energía interna del gas y, en consecuencia, su temperatura aumenta.
- Sistemas de calor, disminuye la energía interna y, consecuencia, su temperatura disminuye.
Ejemplo

Se presenta al cocinar alimentos dentro de una olla exprés, la cual disminuye el tiempo de cocción, pues sirve como depósito para que la temperatura y presión aumenten en el interior conforme transcurre el tiempo manteniendo su volumen constante.
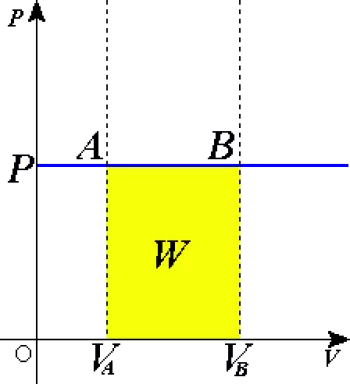
Proceso Isobárico
Un proceso termodinámico en el cual la presión permanece constante se conoce como proceso isobárico. En este proceso, como la presión se mantiene constante, se produce variación en el volumen y, por ende, el sistema puede realizar trabajo o se puede realizar trabajo sobre el.
De acuerdo con la primera ley de la termodinámica, tenemos:
∆U = Q - W
Es decir, que un proceso isobárico tanto el calor transferido como el trabajo ocasionan una variación de energía interna.

Ejemplo
Un ejemplo cotidiano de un proceso isobárico se presenta al hervir agua en un recipiente abierto. Al suministrar energía calorífica al agua, ésta sube de temperatura y se convierte en vapor. El vapor que se obtiene tiene una temperatura superior y ocupa un mayor volumen, sin embargo, la presión se mantiene constante. Desde el inicio la presión es igual a la presión atmosférica.




Hay errores en el calculo del W porque inicialmente dice que el desplazamiento es de 0,5 no de 0,2
ResponderBorrarHola, considero que hay una equivocación al tomar el valor correspondiente a Delta de X, que debe ser 0,5 m y no 0,2 m....pues 0,2m es el coeficiente de fricción entre la superficie y el cuerpo que se mueve al agregar 50j de calor.
ResponderBorrar